Ing Raúl Quercia
Facultad de BioIgeniería
Uner
[expander_maker id=»1″ more=»Leer más» less=»Leer menos»]

[expander_maker id=»1″ more=»Leer más» less=»Leer menos»]
La intususcepción es la introducción de un segmento proximal (intususceptum) en un segmento distal receptor (intususcipiens) del intestino. En adultos es una condición poco frecuente, respondiendo por un 5% de las intususcepciones de todas las edades, y por 1% de las obstrucciones intestinales en los adultos.
Es una condición más frecuente en niños entre 2 meses y 6 años de vida, siendo en ellos una de las causas más frecuentes de obstrucción intestinal. A diferencia de los niños, en que la causa mayormente es idiopática, la gran mayoría de las intususcepciones en adultos (90%) se deben a una causa subyacente (tumor en un 65%, o bien por antecedentes quirúrgicos).
Cuando se produce en el colon, la causa más frecuente es un tumor maligno (linfoma, adenocarcinoma del íleon o colon), mientras que en el intestino delgado, mayormente el factor desencadenante es un tumor benigno (lipoma, pólipo fibroide inflamatorio o tumor de Vanek, pólipo hamartomatoso, divertículo de Meckel).
Los síntomas descritos son dolor abdominal, náusea y vómitos. Además pueden estar acompañados por melena, pérdida de peso, fiebre, y constipación. En adultos, estos síntomas son generalmente crónicos, de varias semanas a meses de duración, aunque puede darse como cuadro de abdomen agudo (ver figura 1).
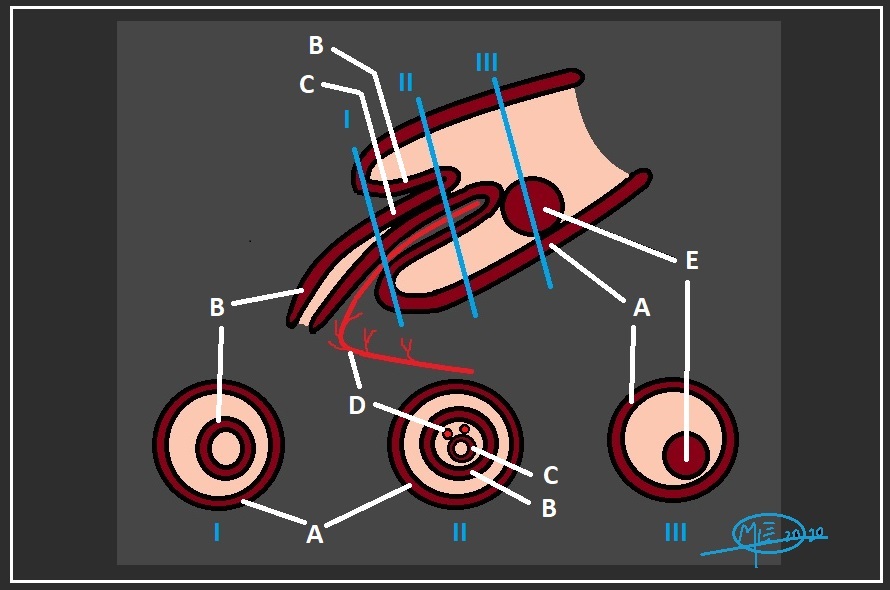
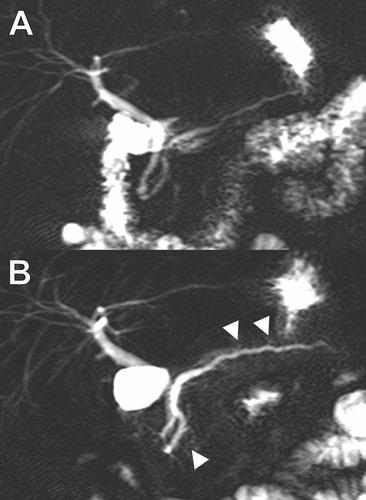
Es una hipótesis generalmente aceptada que la fisiopatogenia consiste en la irritación de la pared intestinal a raíz de una masa (cuando hay una causa subyacente identificable), que actua como punto guía y que genera una alteración del peristaltismo habitual. Esto provoca entonces un punto vulnerable que predispone a la intususcepción (ver figura 2).
[/expander_maker]
[expander_maker id=»1″ more=»Leer más» less=»Leer menos»]
En la radiografía convencional es posible visualizar el signo del menisco, que consiste en una creciente de gas en el lumen del colon delineando el ápice del intususceptum, y el signo de diana conformado por una masa con círculos concéntricos de la grasa mesentérica. El hallazgo de un ciego con gas o heces en su ubicación habitual descarta la intususcepción. Además, el método orienta para descartar obstrucción y/o perforación intestinal. El método tiene una exactitud de 40 a 90% para descartar la intususcepción. Con la introducción retrógrada de bario, se identifica una imagen en resorte del contraste en el espacio luminal entre el segmento proximal y distal. Además es posible observar rayas en forma de cono del contraste a nivel de donde el segmento proximal se introduce en el distal.
La ecografía abdominal tiene una alta sensibilidad (98-100%) y especificidad (88-100%) para el diagnóstico de intususcepción. Se visualiza una masa intestinal grande, por lo general mayor a los 50 mm de diámetro, con desplazamiento de las asas adyacentes. Se observan múltiples círculos concéntricos formados por el centro hipoecogénico del intususceptum, rodeado por un anillo hiperecogénico conformado por el mesenterio y un anillo externo hipoecogénico que consiste en el segmento externo del intususceptum y el segmento receptor (intususcipiens) en sí. Se observa líquido libre peritoneal en hasta un 50% de los casos, sin ser asociado a un mayor riesgo de perforación. Cuando se observa atrapamiento de líquido entre las dos capas serosas del intususceptum (hallazgo en menos del 15% de los casos) orienta hacia la isquemia con menores probabilidades de reducibilidad. El observar señal Doppler en el ápice de la intususcepción se correlaciona con mayores probabilidades de reducibilidad, estando su ausencia asociada a necrosis intestinal.
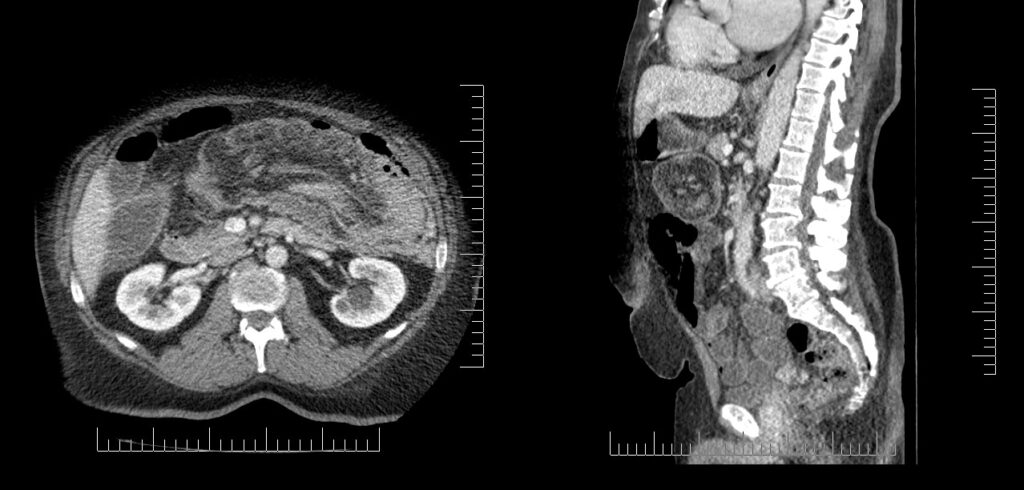
En la TCMC con contraste endovenoso se observa la imagen característica e patognomónica de asa con asa, con o sin mesenterio incluido en el segmento afectado. Si el haz de rayos es perpendicular al intestino se observa el signo de diana con círculos concéntricos, y si es paralelo, se observa masa intestinal con paredes paralelas en forma de salchicha. La ubicación más frecuente es la ileocólica y debe buscarse el punto guía en intestino delgado, colon o apéndice. Se observa en este caso estrechamiento del íleon terminal con topografía alta del ciego, e imagen de resorte intracecal. Los signos inflamatorios con hipercaptación de contraste en la pared intestinal debido a éstasis venosa o falta de relleno del mismo debido a la posterior isquemia revelan fases evolutivas más avanzadas del cuadro aún sin resolución.
Siendo que los signos observados son de carácter patognomónico, la intususcepción no es un diagnóstico de exclusión sino de primera línea. El planteo de diagnósticos diferenciales contempla etiologías diferentes del punto guía para lo cual el examen histopatológico es fundamental (ver figura 3).
Bibliografía
Choi SH, Han JK, Kim SH, Lee JM, Lee KH, Kim YJ, et al. Intussusception in Adults: From Stomach to Rectum. American Roentgen Ray Society, 2004; 183: 691-698. Disponible en línea en: https://www.ajronline.org/doi/pdf/10.2214/ajr.183.3.1830691
Del-Pozo G, Albillos JC, Tejedor D, Calero R, Rasero M, De-la-Calle U, et al. Intussusception in Children: Current Concepts in Diagnosis and Enema Reduction. RadioGraphics 1999; 19:299-319. Publicado por la RSNA en 1999. Accedido en enero 2020, disponible en línea en: https://pubs.rsna.org/doi/pdf/10.1148/radiographics.19.2.g99mr14299

[/expander_maker]
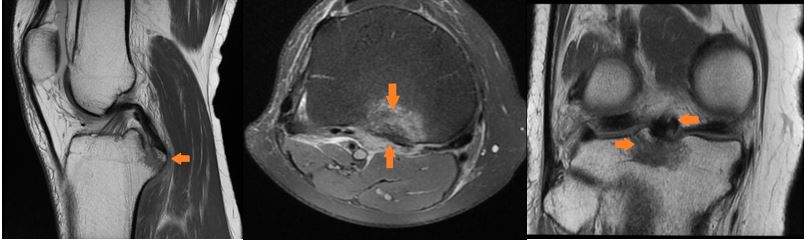
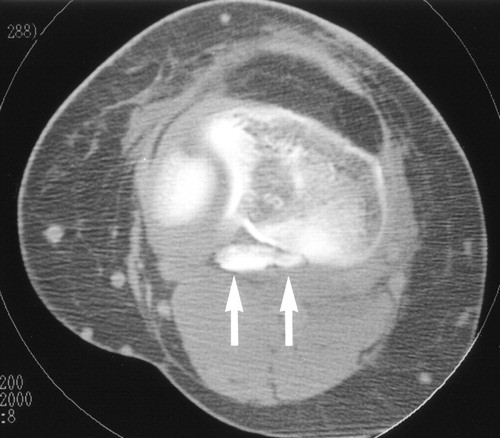
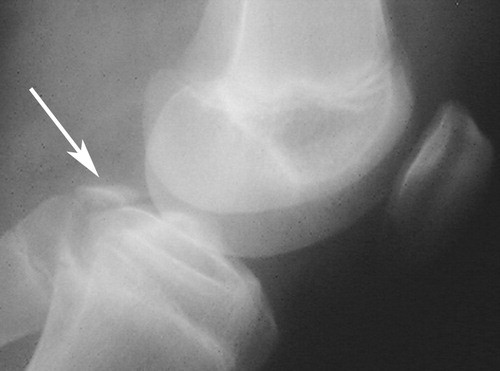
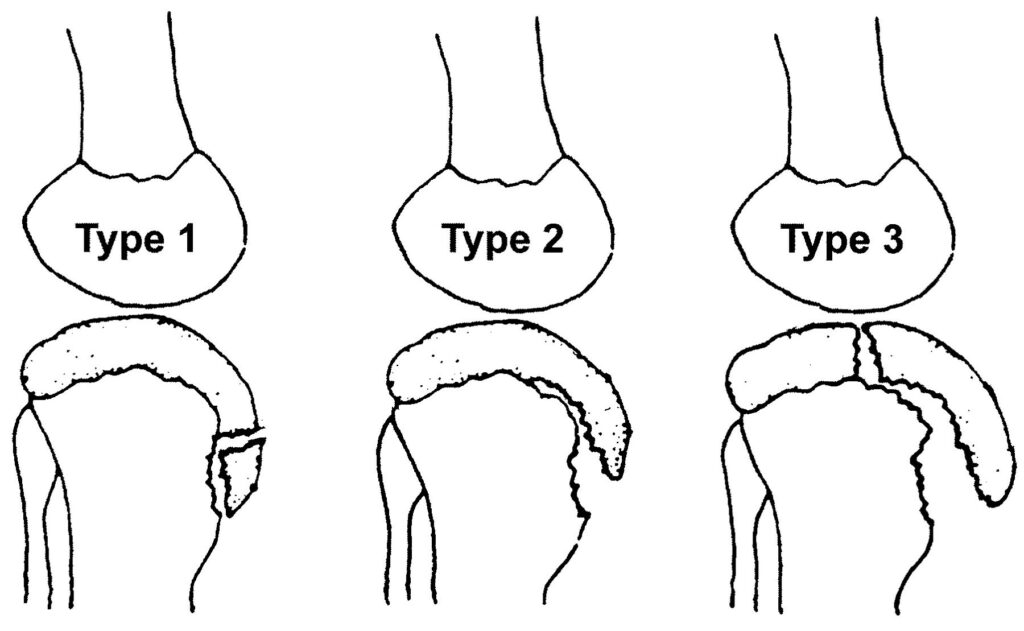

Las roturas del ligamento cruzado posterior son lesiones poco comunes y las fracturas por avulsión del ligamento cruzado posterior son una variante extremadamente rara de esta lesión y ocurren en aproximadamente el 16% de todas las lesiones de rodilla. Las fracturas por avulsión del ligamento cruzado posterior del lado tibial son un tipo de fractura por avulsión de la rodilla que representa la lesión de PCL aislada más común.

DIAGNOSTICO: Fractura avulsiva del ligamento cruzado posterior Tipo I
[expander_maker id=»1″more=»leer mas» less=»leer menos»]
CARACTERISTICAS GENERALES: Las roturas del ligamento cruzado posterior son lesiones poco comunes y las fracturas por avulsión del ligamento cruzado posterior son una variante extremadamente rara de esta lesión. Las fracturas por avulsión del ligamento cruzado posterior del lado tibial son la forma más común de alteración. Se producen como resultado de un accidente automovilístico y especialmente de lesiones en motocicletas, se produce una lesión en el tablero cuando se aplica una fuerza posterior dirigida a la tibia proximal cuando se flexiona la rodilla. Otro mecanismo frecuente es el trauma relacionado con el deporte, en el que el mecanismo es la hiperextensión de la rodilla.
CLAVES DIAGNOSTICAS
Rx: la vista lateral es la más valiosa, se observa una discontinuidad focal de la faceta de PCL en la cara posterior de la tibia. Se debe tener precaución para evitar la subestimación del desplazamiento del fragmento puesto que el PCL inserta aproximadamente 10 mm distal a la línea de la articulación, es posible que no se aprecien fragmentos con menos de 10 mm de desplazamiento en las radiografías.
TC: se presenta como una discontinuidad focal de la cara posterior de la tibia. La tomografía computarizada con reconstrucciones 3D puede proporcionar información adicional sobre el tamaño y la trituración de los fragmentos de la fractura esto es utilizado para la planificación preoperatoria.
RM: En pacientes en los que se sospecha una avulsión pero no se visualiza claramente en las radiografías o el desplazamiento es incierto, se recomienda una MRI. Se aprecia mejor en la vista lateral un fragmento de hueso discreto unido al ligamento cruzado posterior intacto y separado del resto de la tibia.
DIAGNOSTICO DIFERENCIAL
Ruptura ligamento cruzado posterior

[/expander_maker]
.

Características Generales: Sin distinción entre sexos, el higroma quístico o linfangioma es una malformación inespecífica de los canales linfáticos. Se plantea que es una anomalía congénita de los vasos linfáticos yugulares, que trae como consecuencia el drenaje no adecuado de la linfa
El linfangioma se desarrolla a partir de los sacos linfáticos secundarios cuando son secuestrados por los primarios durante la vida embrionaria. Se propone que esta malformación es el resultado de segmentos del saco linfático yugular que están fuera de sitio o de la falla de los espacios linfáticos para conectar con los principales canales linfáticos y constituye un tumor líquido claro, limpio y transparente
[expander_maker id=»1″ more=»Leer más» less=»Leer menos»]
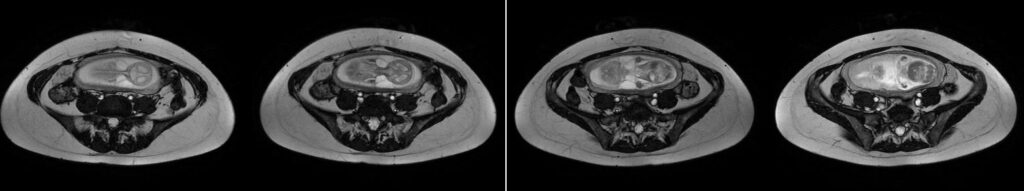
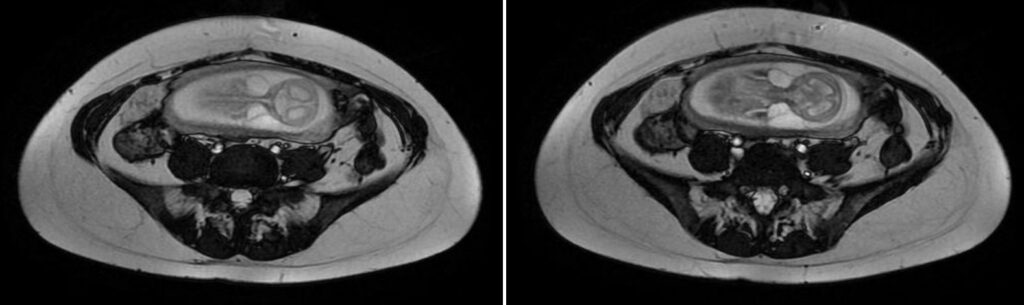
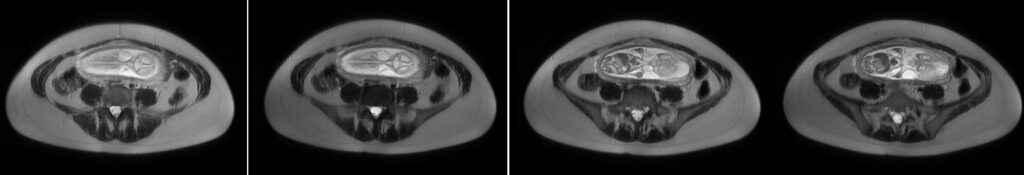
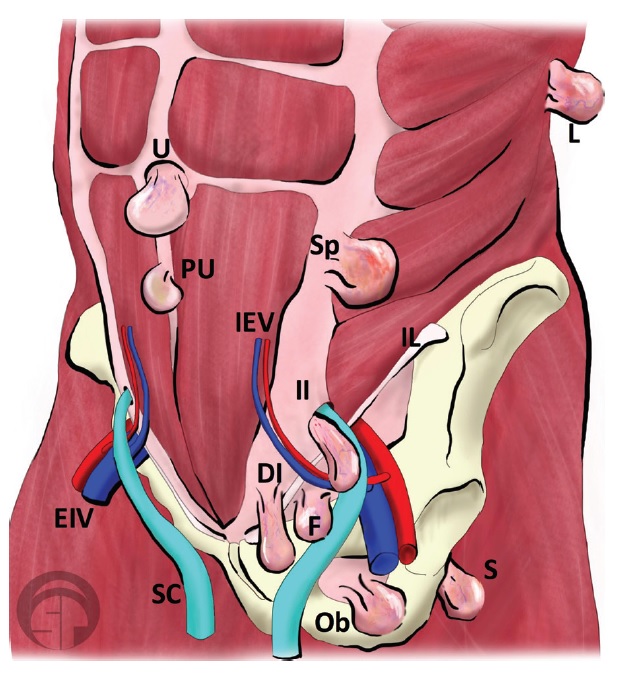
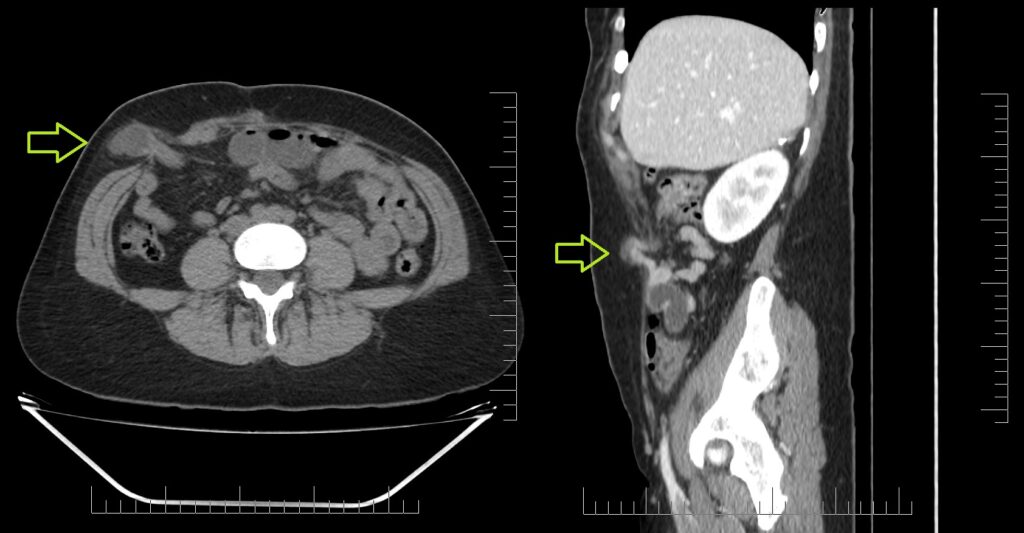
Las hernias de Spiegel son protrusiones poco frecuentes de la pared abdominal, respondiendo por un 2% y debiéndose a una debilidad congénita en la capa posterior de la fascia transversa. Se produce en la unión entre la línea semilunar (que marca el borde de los músqulos abdominales rectos, desde el noveno cartílago costal hasta la sínfisis púbica) y la línea semicircular (o bien línea arcuata marca el punto por debajo del cual únicamente la fascia transversal está posterior a los músculos rectos). Otra definición por su topografía es la de protrusiones ubicados entre el ombligo y 10 cm lateral a la línea media. El diagnóstico clínico es difícil por su topografía, siendo a menudo interparietal entre capas musculares o fascias de la pared abdominal. El orificio de la hernia es además de tamaño pequeño y contiene grasa del omento o peritoneo o asas del intestino delgado.
La ultrasonografía es un método de rápida disponibilidad para descartar condiciones que implican riesgo de vida en la valoración preoperatoria de complicaciones (obstrucción intestinal, incarceración, estrangulación, etc). Una hernia encarcerada de contenido graso, líquido o mixto puede esperar mientras que las asas encarceradas son indicación de cirugía urgente. Permite la visualización del engrosamiento de las asas encarceradas. Líquido libre en saco herniario es muy sugestivo de proceso agudo.
La tomografía computada es una modalidad ideal por ofrecer detalles anatómicos superiores, siendo un diagnóstico clínico difícil. Defecto de la fascia en la ubicación mencionada. Facilita detección de complicaciones asociadas. Imágenes axiales con reconstrucciones de igual o menor a 2.5 mm por sección, con cambios de posición y Valsalva para detección de hernias sutiles. Con contraste endovenoso y vía oral para valorar su aporte sanguíneo y asas intestinales involucradas.
La resonancia magnética no es el estudio de elección como primera línea para las hernias abdominales, especialmente en el contexto de una complicación aguda. La tomografía computada es más accesible y costo-eficaz para este fin. Para hernias ocultas, la sensibilidad de ultrasonografía, tomografía computada y resonancia magnética son de 33%, 54% y 91% respectivamente por lo que es de utilidad cuando el diagnóstico aún no se ha podido realizar con las otras modalidades o cuando se sospecha causa muscular, ligamentaria o tendinosa del dolor en primera instancia.
Tener conocimiento de la ubicación topográfica y de las características de imágenes de esta entidad puede orientar la adquisición diagnóstica ante signos clínicos que pueden no ser concluyentes y facilitar un abordaje terapéutico eficaz y precoz cuyo valor es de vital importancia ante sus complicaciones agudas.
Bibliografía
1. Cabarrus MC, Yeh BM, Phelps AS, OU JJ, Behr SC. From Inguinal Hernias to Spermatic Cord Lipomas: Pearls, Pitfalls, and Mimics of Abdominal and Pelvic Hernias. RadioGraphics 2017; 37:2063-2082. Disponible en:
https://pubs.rsna.org/doi/10.1148/rg.2017170070
2. Harrison LA, Keesling CA, Martin NL, Lee KR, Wetzel LH. Abdominal Wall Hernias: Review of Herniography and Correlation with Cross-sectional Imaging. RadioGraphics 1995; 15:315-332. Disponible en:
https://pubs.rsna.org/doi/pdf/10.1148/radiographics.15.2.7761638
3. Aguirre DA, Santosa AC, Casola G, Sirlin CB. Abdominal Wall Hernias: Imaging Features, Complications, and Diagnostic Pitfalls at Multi-Detector Row CT. RadioGraphics 2005; 25:1501-1520. Disponible en:
https://pubs.rsna.org/doi/full/10.1148/rg.256055018

[/expander_maker]
La pancreatitis se define como la inflamación del páncreas y se considera la enfermedad pancreática más común en niños y adultos. Las imágenes desempeñan un papel importante en el diagnóstico, evaluación de la gravedad, el reconocimiento de las complicaciones, la pancreatitis puede ser aguda; Representando un proceso inflamatorio agudo del páncreas, o crónico; que progresa lentamente con lesión inflamatoria continua y permanente del páncreas.
[expander_maker id=»1″ more=»Leer más» less=»Leer menos»]
La pancreatitis crónica es una enfermedad inflamatoria caracterizada por un daño estructural progresivo e irreversible del páncreas que produce un deterioro permanente de las funciones exocrinas y endocrinas.
La incidencia de pancreatitis crónica es de cinco a doce casos por cada 100000 personas por año; representando más de 120000 visitas ambulatorias y 50000 hospitalizaciones al año, el consumo de alcohol representa la mayoría (80%) de los casos de pancreatitis crónica en adultos en países desarrollados; mientras que la desnutrición es la causa más común en todo el mundo.
El diagnóstico de pancreatitis crónica (PC) se realiza mediante una combinación de síntomas clínicos (por ejemplo, dolor abdominal, malabsorción, diabetes mellitus), pruebas de la función pancreática (por ejemplo, elastasa fecal-1) y anomalías morfológicas observadas en las imágenes del parénquima pancreático, el conducto pancreático y el tracto biliar (por ejemplo, calcificaciones, lesiones ductales, seudoquistes).
Se usan varios tipos de imágenes para el estudio de la PC, la ecografía endoscópica, la colangiopancreatografía retrógrada endoscópica (CPRE), la resonancia magnética (RM), la tomografía computarizada (TC) y la ecografía.
Las imágenes desempeñan un papel importante en el diagnóstico y el tratamiento de la PC, las características de imagen de la pancreatitis crónica se pueden dividir en hallazgos tempranos y tardíos.
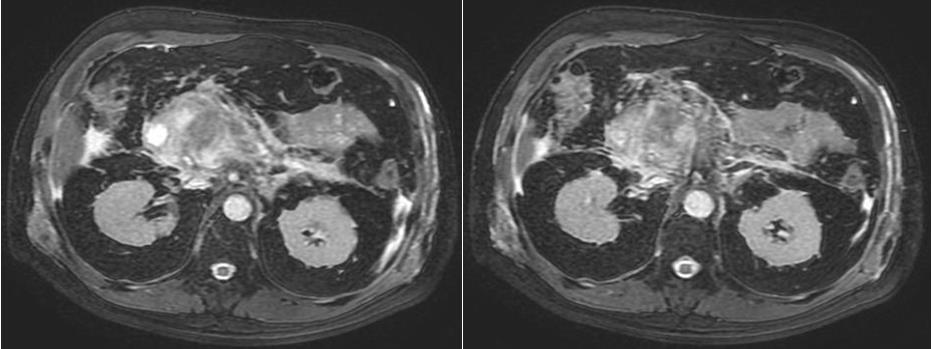
La sensibilidad de la ecografía y la tomografía para la detección de a pancreatitis crónica temprana es baja, ya que, en etapas iniciales, no serán observables dichos cambios, estos cambios del parénquima pancreático podrían preceder los cambios ductales, por lo tanto, la RM juega un rol importante en el diagnostico en etapas tempranas de esta entidad.
El páncreas normal mejora uniforme e intensamente en las imágenes de fase arterial temprana potenciadas en T1 y muestra un lavado rápido del gadolinio en las imágenes subsiguientes. Por el contrario, un páncreas con fibrosis crónica y atrofia glandular presenta un realce disminuido y heterogéneo en las imágenes de la fase arterial y una captación relativamente incrementada en las imágenes tardías, esta baja intensidad de la señal en T1 fat sat refleja la pérdida de la proteína acuosa en los acinos del páncreas y la disminución del realce en las imágenes de la fase capilar refleja la interrupción del lecho capilar normal y el aumento de la inflamación crónica y la fibrosis.
Los hallazgos de colangiopancreatografía por resonancia magnética (CPRM) en la pancreatitis crónica temprana a menudo demuestran un conducto pancreático principal normal con ramas de conductos laterales dilatados e irregulares.
La colangiopancreatografía retrógrada endoscópica (CPRE) se considera la prueba estándar de referencia para detectar cambios tempranos en los pacientes con pancreatitis crónica, La colangiopancreatografía por RM (CPRM) es una alternativa para los pacientes en los que la CPRE falló y en los que no pueden tolerar este procedimiento.
La ecografía endoscópica tiene una alta capacidad para la detección de cambios morfológicos tempranos y es un procedimiento menos invasivo que la CPRE.
La Pancreatitis crónica tardía:
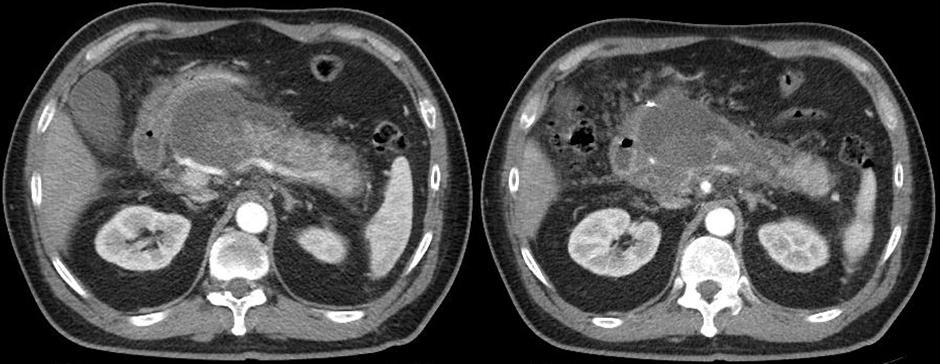
La TC tiene una sensibilidad del 60% al 95% en el diagnóstico de enfermedad avanzada, mostrando con precisión los cambios en el parénquima pancreático, estos hallazgos incluyen la dilatación del conducto pancreático principal y sus ramas laterales; hasta en el 68% de los pacientes. El contorno ductal puede ser liso, moldeado o irregular, las calcificaciones intraductales, que es el hallazgo más específico de la pancreatitis crónica y se observa en casi la mitad de los pacientes con pancreatitis y atrofia del parénquima, sin embargo, la atrofia del parénquima no es específica ni sensible y se ve normalmente con el envejecimiento. Las calcificaciones se asocian con mayor frecuencia a PC causada por consumo de alcohol.
En las imágenes de MR de los pacientes con pancreatitis crónica tardía o avanzada se observa disminución de la intensidad de la señal del páncreas en imágenes T1 fat sat, y un realce disminuido en las imágenes inmediatas post-contraste, y un realce progresivo del parénquima en el post-contraste tardío de 5 minutos. Lo cual reflejando el patrón de realce del tejido fibroso.
La CPRM en la fase avanzada de la PC demuestra la dilatación del conducto pancreático principal con ectasia de las ramas laterales, con estenosis ductal pancreática, irregularidades y cálculos intraductales, apareciendo como defectos de relleno hipointensos.
La pancreatitis crónica puede afectar exclusivamente a la cabeza pancreática en el 30% de los casos, lo que resulta en una cabeza pancreática focalemente agrandada, hallazgos que pueden simular un adenocarcinoma, tanto la pancreatitis crónica como el adenocarcinoma muestran características de imagen similares en la TC y la RM debido a la abundante fibrosis y obstrucción ductal ambas se ven como lesiones hipodensas en la TC, levemente hipointensas en imágenes ponderadas en T1 y señales heterogéneas levemente hiperintensas en las imágenes ponderadas en T2. Sin embargo, ciertas características de imagen son útiles en la distinción de la cabeza del páncreas agrandada de la pancreatitis crónica de adenocarcinoma.
Diferenciación de las características de la imagen entre la pancreatitis crónica y el adenocarcinoma pancreático
| Pancreatitis crónica | Adenocarcinoma pancreático |
| Presenta una textura glandular, plumosa o de mármol similar a la del páncreas restante. | Lesión masiva definible y circunscrita es a menudo diagnóstica de tumor, lo que altera la arquitectura subyacente y provoca la pérdida de detalles anatómicos |
| Realce pancreático heterogénea con presencia de señal de vacío (quistes y calcificaciones) en las imágenes inmediatas post-gadolinio | Realce irregular, heterogéneo, disminuido con el gadolinio en comparación con el parénquima pancreático adyacente |
| Dilatación irregular del conducto pancreático principal con estrechamiento gradual. Presencia de múltiples calcificaciones intraductales ( hallazgo más específico) | Corte abrupto del conducto pancreático con dilatación proximal significativa +/- presencia de signo del conducto doble. Muy pocos cálculos ductales en comparación con pancreatitis crónica |
| Dilatación del conducto pancreático principal con ectasia de las ramas laterales, dando una apariencia de cadena de lagos. | Dilatación mínima de las ramas laterales. |
| Sin encapsulamiento vascular, ni linfadenopatía significativa o metástasis a distancia. | Recubrimiento vascular, linfadenopatía o metástasis a distancia. |
Mundo J Gastrointest Patofisiol. 2014 15 de agosto; 5 (3): 252–270.
Bibliografia:
Y. Issa,1 M. A. Kempeneers, H. C. van Santvoort, T. L. Bollen,2 S. Bipat, and M. A. Boermeester Diagnostic performance of imaging modalities in chronic pancreatitis: a systematic review and meta-analysis, Eur Radiol. 2017; 27(9)
Frank H. Miller, Ana L. Keppke, Anubha Wadhwa, John N. Ly, MRI of Pancreatitis and Its Complications: Part 2, Chronic Pancreatitis American Journal of Roentgenology Volume 183, Issue.
Kiran K Busireddy, Mamdoh AlObaidy, Miguel Ramalho, Janaka Kalubowila, Liu Baodong, Ilaria Santagostino, and Richard C Semelka, Pancreatitis-imaging approach, World J Gastrointest Pathophysiol. 2014 Aug 15; 5(3)
[/expander_maker]


[expander_maker id=»1″ more=»Leer más» less=»Leer menos»]
Es común en los varones de edad mayor el padecer sintomatología por una glándula prostática aumentada de tamaño, siendo la prevalencia de 50-60% en la población masculina a los 60 años de edad. El diagnóstico de hiperplasia prostática benigna es histológica ante la presencia de hiperplasia glandular y estromal. El componente glandular del agrandamiento es el principal responsable de los síntomas obstructivos mientras que la hiperplasia estromal lleva a una mayor resistencia del tejido.
En la hiperplasia prostática benigna, es la zona de transición o parte interna de la glándula la que aumenta de tamaño incorporando un aspecto hipoecogénico en la valoración ecográfica. Pueden surgir nodulaciones benignas hipo, iso o hiperecogénicos en esta zona lo cual se traduce en un aspecto heterogéneo de la glándula. Ante un aspecto hipoecogénico y bien delimitado de nódulos ubicados en la zona de transición, se puede concluir en la mayoría de los casos que son de carácter probablemente benigno, si bien los nódulos ubicados en la periferia pueden ameritar biopsia para descartar malignidad, aún en el contexto de la hiperplasia prostática benigna.
Es de mención que la sintomatología no guarda relación con el grado de hiperplasia siendo que la alteración de la función urinaria se debe a múltiples factores como las del sistema nervioso central, la columna vertebral y alteraciones de la vejiga y uretra, así como también de la próstata. Es posible encontrar un tamaño prostático aumentado sin síntomas o bien sintomatología de obstrucción miccional ante una próstata normal o de tamaño pequeño, por lo multifactorial de los problemas miccionales.
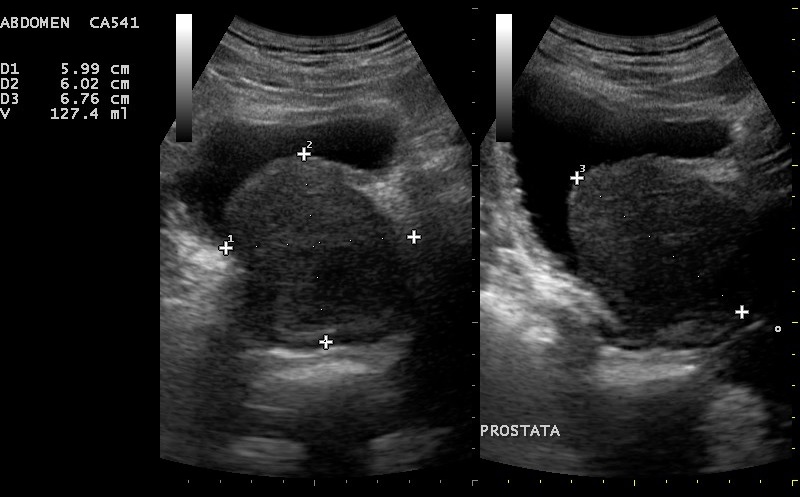
La modalidad de elección de la ecografía en el contexto de prostatismo es la que transvesical, en la que se emplea una vejiga urinaria con repleción de orina para visualizar la glándula prostática colocando el transductor sobre la pared abdominal en la región suprapúbica. Esta valoración permite identificar aumentos en las dimensiones así como la cuantificación del volumen pre y postmiccional de la vejiga, y la presencia eventual de hidronefrosis asociada.
La modalidad transrectal queda reservada para el cáncer de próstata y para aquellos casos de hiperplasia prostática benigna en que se precisan mediciones más exactas de su dimensión para cuantificar la respuesta al tratamiento farmacológico.
Desde sus inicios como modalidad diagnóstica, la tomografía computada tiene un rol limitado para la detección y valoración de la hiperplasia prostática benigna, dada su relativa desventaja para la diferenciación tisular frente a la ultrasonografía y la resonancia nuclear magnética. Como dato de interés es de mencionar que la combinación en tiempos modernos de la tomografía computada con modalidades de medicina nuclear como es el PSMA-PET está haciendo avances para la valoración de recurrencias de cáncer de próstata con mayor sensibilidad en las fases tempranas de la recurrencia.
Las imágenes obtenidas por resonancia nuclear magnética poseen resolución de contraste muy superior a otros métodos por lo que presentan ventajas para la valoración de esta entidad clínica, aún para su diferenciación del cáncer de próstata. Son las imágenes ponderadas en secuencia T2 las que permiten una mayor definición del parénquima prostático, con cortes sagitales y axiales. Dependiendo de la composición y proporción glandular y estromal de la hipertrofia, las imágenes pueden ser hipointensas o bien hiperintensas según su contenido hídrico. Un nódulo hiperintenso se debe a acúmulo líquido secretor de forma quística por mecanismo de ectasia. El aspecto hipointenso se debe a componentes fibromusculares de la glándula hipertrófica.
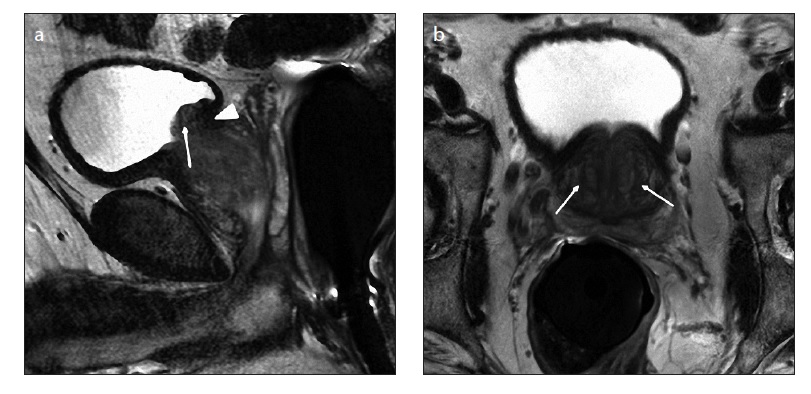
Según su compromiso topográfico de diferentes zonas, la hiperplasia prostática benigna es clasificada por imágenes de resonancia nuclear magnética en siete tipos. En el tipo 0, la glándula posee un volumen igual o menor a 25 ml demostrando escaso o ningún agrandamiento de una zona. El tipo 1 muestra agrandamiento bilateral de la zona de transición mientras que el tipo 2, agrandamiento retrouretral. El tipo 3 combina los anteriores con agrandamiento bilateral de la zona de transición y retrouretral. El tipo 4 muestra agrandamiento pediculado único o múltiple. El tipo 5 combina el agrandamiento pediculado con agrandamiento de la zona de transición y/o retrouretral. El tipo 6 requiere agrandamiento subtrigonal o ectópico mientas que la última categoría, el tipo 7, engloba otras combinaciones de agrandamientos a nivel de la próstata.
Ante el desafío de diferenciar el cáncer de próstata de una hiperplasia estromal hipointensa en T2 o bien una hiperplasia glandular hiperintensa, es de utilidad el empleo de imágenes con mapa ADC, siendo la restricción a la difusión diferente para estas tres entidades. Siendo la hiperplasia estromal más celular y más denso, con menos líquido extracelular que la hiperplasia glandular, tiene un valor menor de ADC. El cáncer de próstata tiene un valor menor de ADC que la hiperplasia prostática benigna, especialmente en comparación con el tipo glandular. Esto puede ayudar en el proceso importante de diagnóstico diferencial entre estas entidades, cuya importancia reside en la morbimortalidad de la entidad maligna.
Bibliografía

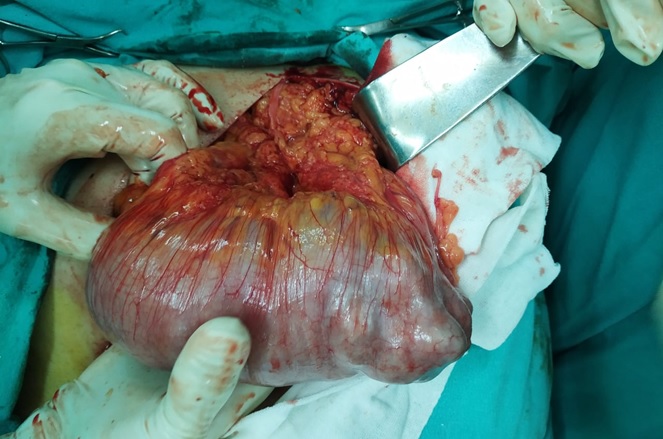
La leiomiomatosis uterina o también conocida como fibroma uterino aunque su origen es a partir de células de músculo liso, es uno de los tumores pélvicos más comunes en mujeres, puede presentarse de manera asintomática o con síntomas como sensación de masa a nivel pélvico, dolor, hipermenorrea, este último como indicación para procedimiento quirúrgico.
[expander_maker id=»1″ more=»Leer más» less=»Leer menos»]
Los leiomiomas son hormono-dependiente por lo que en condición de embarazo pueden generar alteraciones en la presentación, inserción de la placenta y contracciones, su morfología generalmente es sólida, redonda u ovoide, no encapsulado, múltiple o solitario en un 2%.
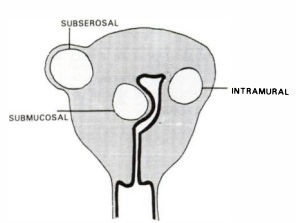
Su ubicación es variable, dentro del miometrio o intramural, por debajo del peritoneo que recubre el cuerpo uterino o subseroso, submucoso ubicados en proximidad inmediata al endometrio y los pediculados.
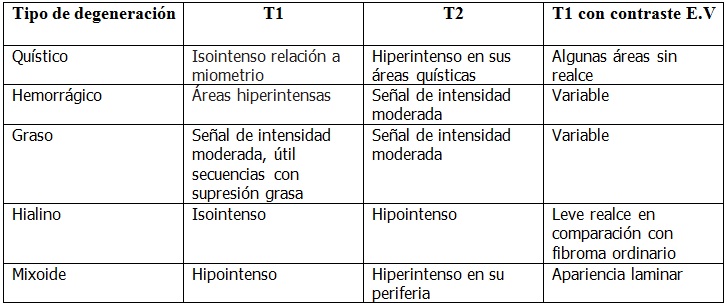
Hay diferentes variantes de los fibromas pudiendo dividirse como; fibroma no degenerado o fibroma con degeneración hialina, quística, hemorrágica, grasa, mixoide, y como lado extremo su transformación maligna a leiomiosarcoma que si bien es rara es importante tener en cuenta que no es posible diferenciarlos imagenológicamente.
Las características imagenológicas dependen de su presentación y variabilidad mencionada anteriormente, siendo detectados la mayoría de las veces por estudio con ultrasonido.
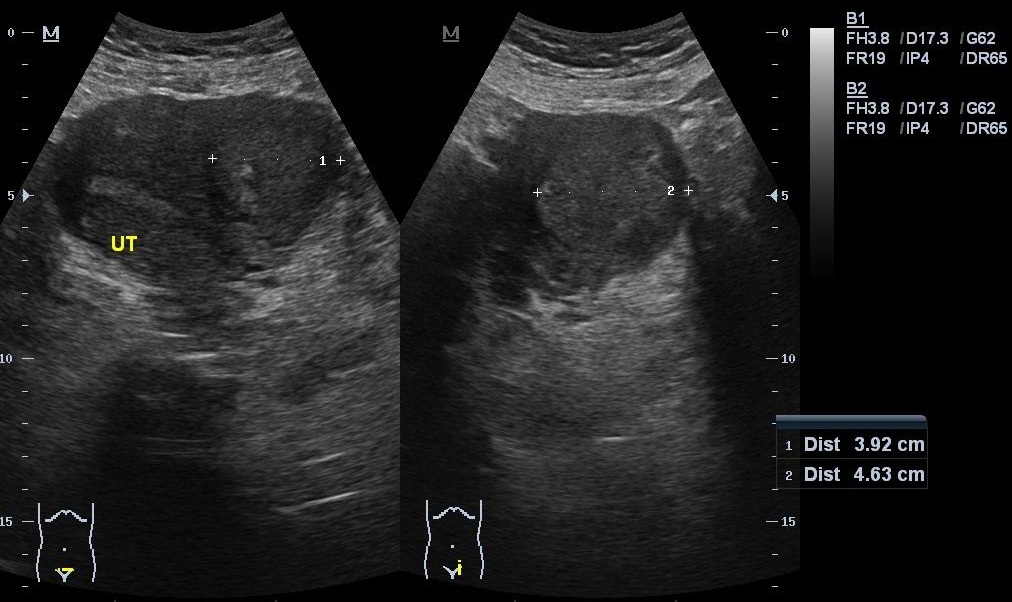
ULTRASONIDO: Imagen bien circunscripta, hipo, iso o hiperecoica, focos con sombra acústica posterior en casos de calcificación, áreas quísticas
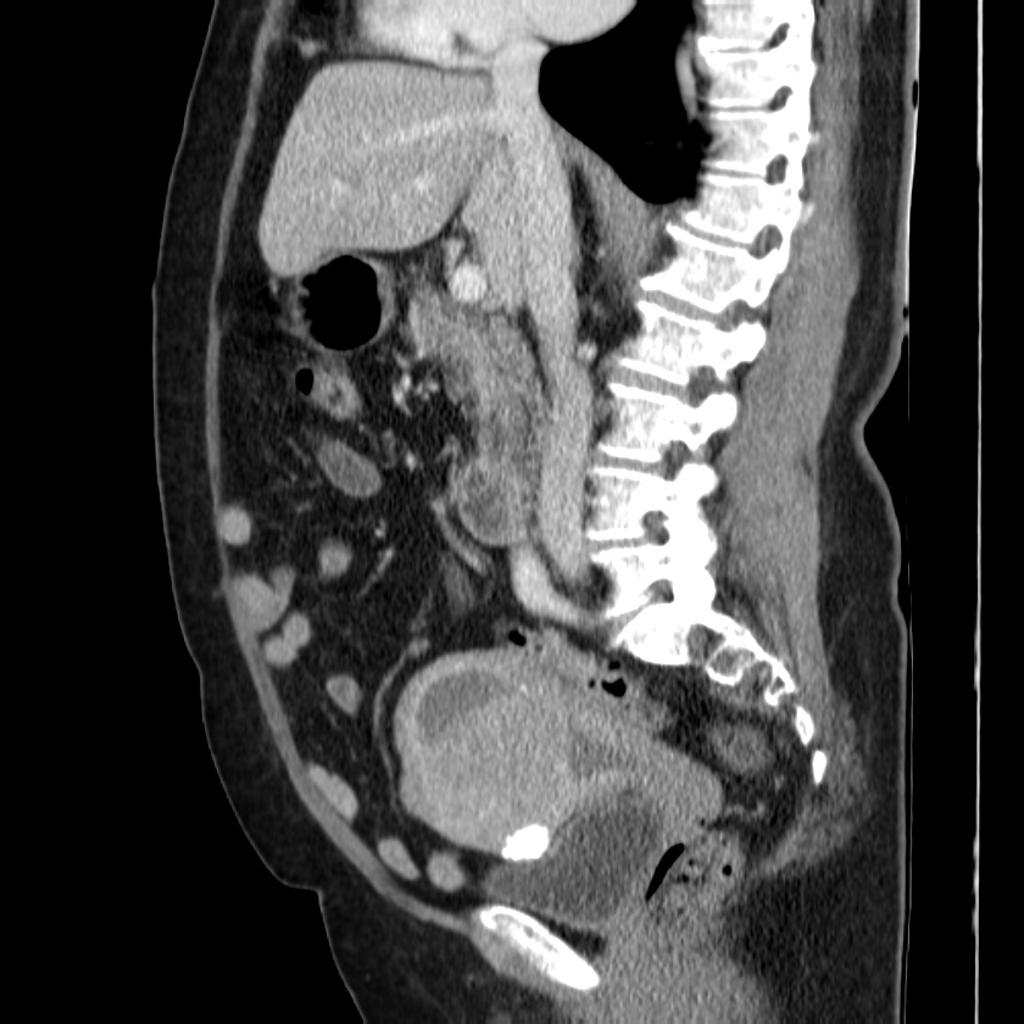
TCMC: Imagen de consistencia sólida, con alteración sobre la morfología uterina, lobulaciones, obliteración de la cavidad uterina dependiendo su ubicación, tamaño y densidad variable, pudiendo presentar calcificaciones periféricas
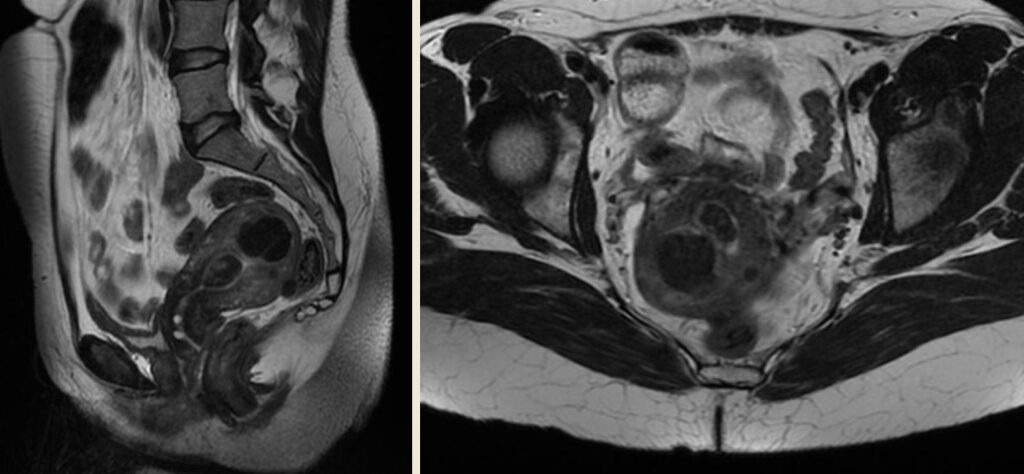
MRI: Los fibromas sin degeneración se presentan en secuencia T1 como iso a hipo intenso en relación al miometrio normal, T2 hipointenso o con señal de vacío de flujo en casos de vascularización T1 con contraste, realce variable
En la tabla siguiente se presenta un resumen por MRI de los fibromas con sus distintos tipos de degeneración
A continuación caso del servicio, paciente de 33 años femenina con sensación de masa en región pélvica 3 meses de evolución asociado a hipermenorreas
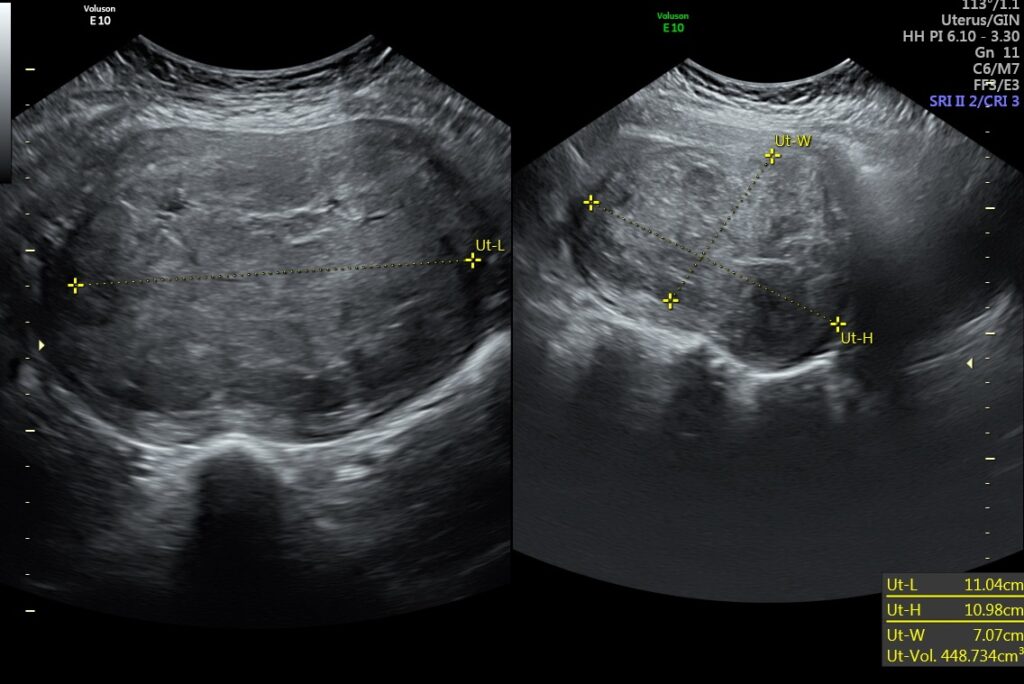
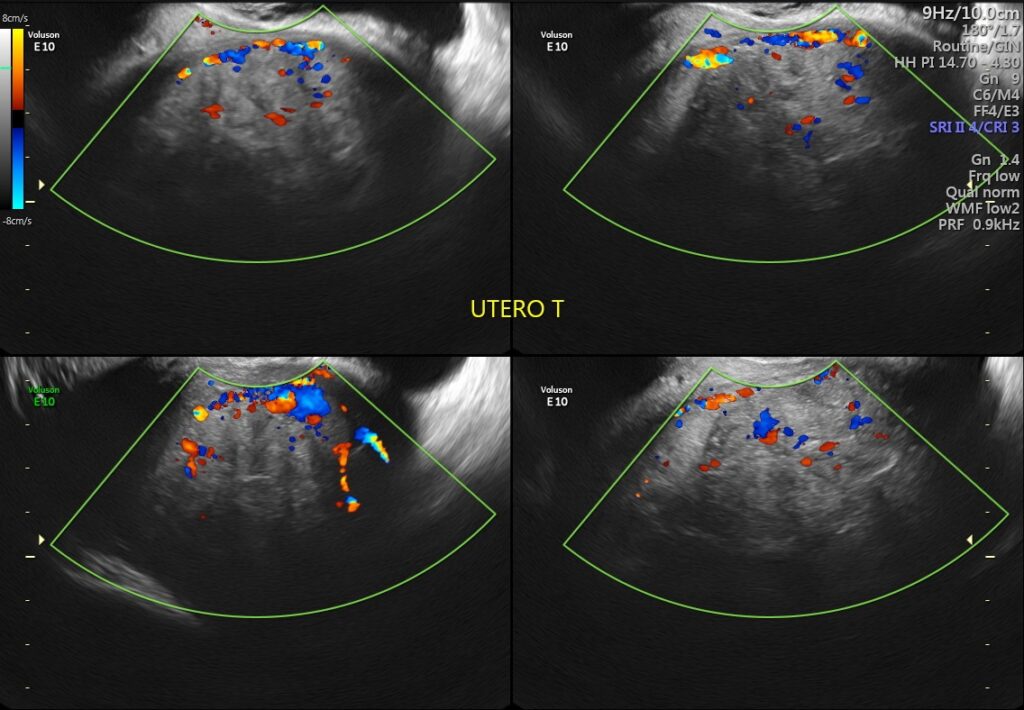
Útero en AVF cuyo diámetro longitudinal es de 129mm, anteroposterior de 89mm y transverso de 127mm, Llama la atención imagen de ecogenicidad heterogénea de predominio hipoecogénica, a nivel fúndica y corporal intramural posterior, la cual desplaza hacia anterior el endometrio, dicha lesión presenta captación Doppler color periférica y central, con medidas de 110mm en trasverso por 109mm en longitudinal y 70mm en anteroposterior, los hallazgos descritos anteriormente deberán ser correlacionados con antecedentes clínicos e histopatológico no pudiendo descartar origen neoproliferativo
Bibliografía
Review of Leiomyoma Variants – Elizabeth Kagan Arleo1, Peter E. Schwartz2, Pei Hui and Shirley McCarth – Department of Obstetrics and Gynecology, Yale University School of Medicine, New Haven, CT, Department of Pathology, Yale University School of Medicine, New Haven, CT, Department of Diagnostic Radiology, Yale University School of Medicine, New Haven, CT – AJR October 2015, Volume 205
CT appearance of uterine leiomyomas – J Casillas, R C Joseph, J J Guerra, Jr – RSNA Radiographics 1 de noviembre de 1990

[/expander_maker]