
Definición: Históricamente, se han utilizado varios términos para describir la histiocitosis de células de Langerhans (HCL) en función de los patrones específicos de la enfermedad: granuloma eosinofílico para la infiltración histiocítica de una o más lesiones óseas líticas; Enfermedad de Hand-Schüller-Christian para la tríada clínica de lesiones óseas, exoftalmos y poliuria resultante de diabetes insípida; o enfermedad de Letterer-Siwe para un curso fulminante de afectación multisistémica que incluye el hígado, el bazo, la piel, los huesos y las células hematopoyéticas.
Etiología: La HCL es el trastorno histiocítico más común, caracterizado por la acumulación y proliferación de células análogas a Langerhans derivadas de la médula ósea, puede afectar a cualquier grupo de edad desde la infancia hasta la edad adulta. Histológicamente, hay abundantes histiocitos positivos para CD1a y positivos para CD207, a menudo mezclados con numerosos eosinófilos.
La identificación de los gránulos de Birbeck en el examen ultraestructural condujo a la suposición original de que la HCL se deriva de las células de Langerhans en la piel y los ganglios linfáticos. Sin embargo, evidencia adicional favorece que la HCL se origina a partir de células dendríticas mieloides derivadas de la médula ósea.
Reseña clínica: El dolor y la hinchazón son los síntomas de presentación habituales.
Tratamiento: Las opciones de tratamiento se disputan, y el curso a menudo benigno y la curación espontánea de estas lesiones están bien documentados. Existen muchas terapias probadas y efectivas que incluyen escisión amplia, legrado con o sin injerto óseo, esteroides intralesionales y radiación local de haz externo. El tratamiento quirúrgico a menudo conlleva una recuperación prolongada y tiene morbilidades asociadas significativas. Los avances en la intervención guiada por imágenes ofrecen nuevas opciones para el tratamiento del granuloma eosinofílico del hueso.
El conocimiento (descubrimientos genómicos) también ha llevado al desarrollo de una terapia molecular dirigida para la histiocitosis, que ha abierto una nueva era de enfoques de medicina de precisión para tratar esta enfermedad enigmática. (Inhibidores de la vía de la RAF).
Diagnóstico por imagen:
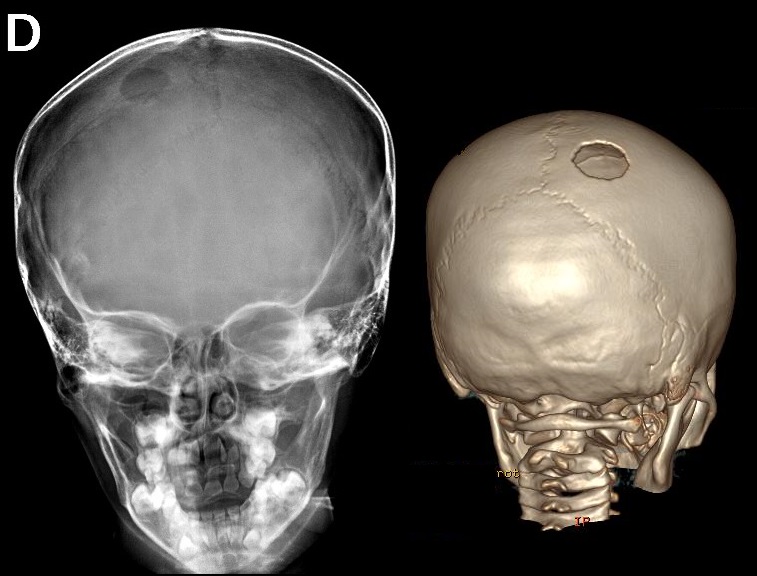
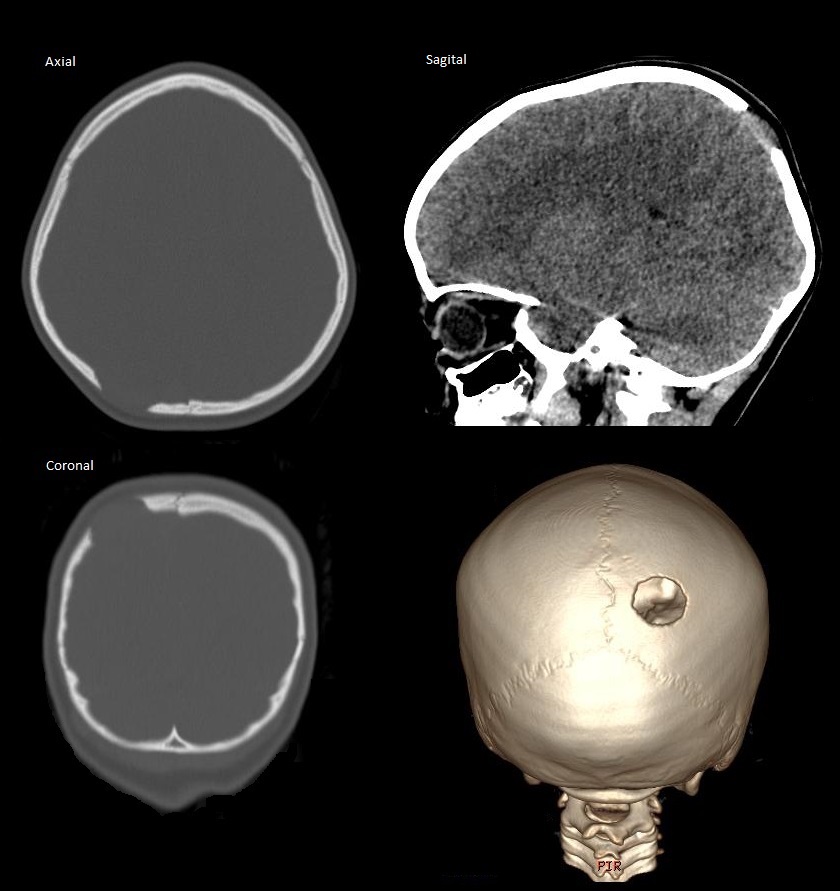
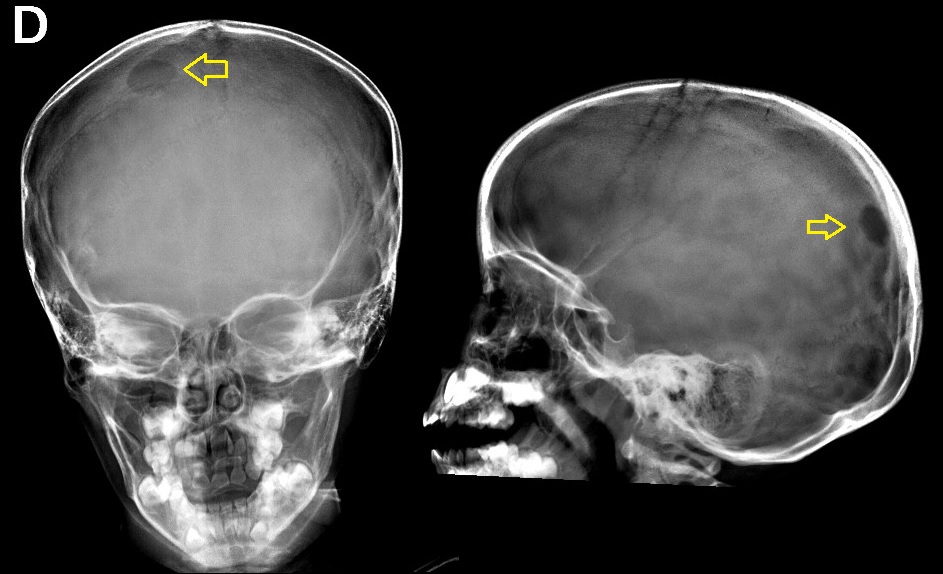
- Rx: Suelen describirse como lesiones líticas «punzonadas» sin reacción perióstica o esclerosis reactiva. En pacientes con histiocitosis de células de Langerhans, la destrucción asimétrica de las tablas internas y externas del cráneo produce una apariencia biselada.

- U.S: La histiocitosis de células de Langerhans se manifiesta como una masa sólida con una vascularización mínima, que se extiende desde la superficie diploica.
- TC: Defecto lítico, biselado (tabla interna > tabla externa).

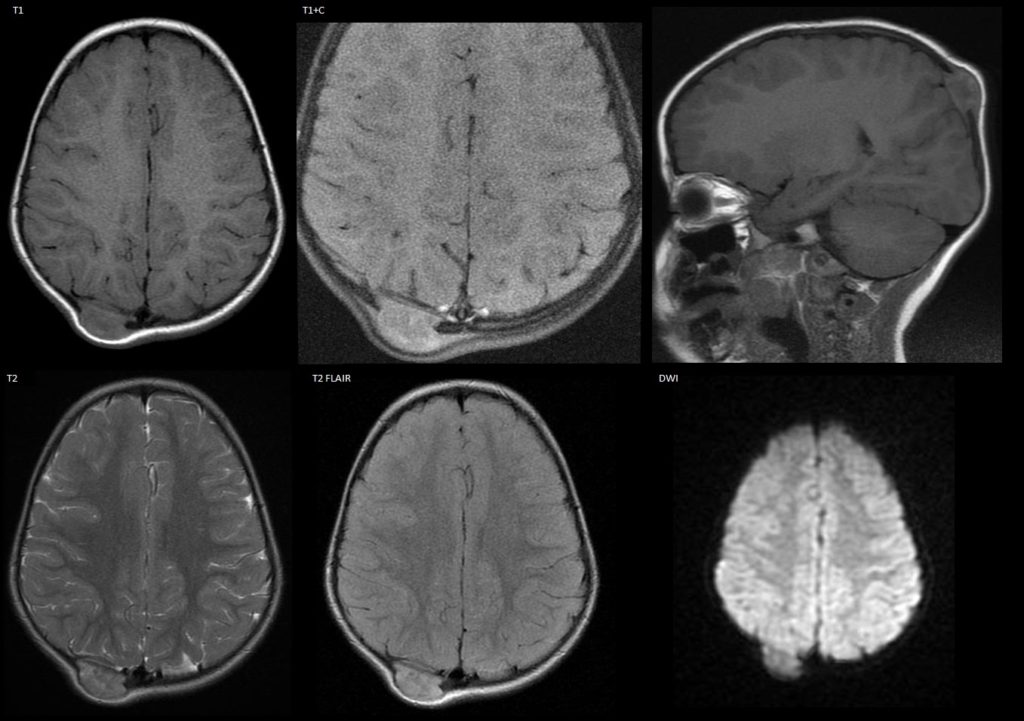
- MRI: (HCL tiene características agresivas en la RM, lo que demuestra edema circundante de la médula ósea, reacción perióstica, festoneado y edema de tejidos blandos, que imitan los hallazgos de malignidad o infección)
- T1: Masa de tejido blando en el lugar de la lisis ósea (± acortamiento en T1 debido a histiocitos cargados de lípidos). T1+C: masas de tejido blando realzadas (definidas o infiltrativas).
- T2: Cráneo, mastoides, lesiones orbitales/faciales: las masas de tejido blando muestran una leve hiperintensidad en T2.


- Gammagrafía ósea: TC gammagrafía ósea: variable (frío / caliente)
Diagnóstico diferencial:
- Quirúrgicas: (agujero por fresa, derivación, defecto quirúrgico)
- Epidermoide: En imagen se comportan tanto en la TC como en la RM como lesiones con valores de atenuación e intensidad similar a los del agua (hipointensas en T1 e hiperintensas en T2) aunque en función de su contenido pueden tener una apariencia variable. Normalmente captan parcialmente tras la administración de medio de contraste pudiendo ocasionalmente no hacerlo
- Dermoide: En imagen suelen comportarse como la grasa en TC y RM (hiperintensos en todas las secuencias). Ocasionalmente pueden mostrar zonas calcificadas debido a la presencia de saponificación de la grasa.
- Metástasis: La mayoría de estas lesiones son múltiples y puramente líticas, aunque en los casos de la mama y la próstata pueden ser lesiones blásticas puras o mixtas. metástasis líticas aparecen como lesiones con márgenes irregulares o con patrón óseo permeativo que invaden tanto la tabla interna como la externa, asociando característicamente masas de partes blandas en mayor o menor grado. En RM se comportan normalmente como isointensas con la sustancia gris en secuencias T1 siendo fácilmente diferenciables de la hiperintensidad que muestra la médula normal en esta secuencia, e hiperintensas en T2, realzando intensamente tras la administración de gadolinio. Frecuentemente asocian otras lesiones metastásicas intraparenquimatosas
Bibliografía
US of Pediatric Superficial Masses of the Head and Neck, Anmol Gupta Bansal, Rebecca Oudsema, Joy A. Masseaux, Henrietta Kotlus Rosenberg, RadioGraphics Volumen 38, Issue 4Jul 1 2018.
Imaging of Histiocytosis in the Era of Genomic Medicine, Hyesun Park, Mizuki Nishino, Jason L. Hornick, Eric D. Jacobsen, RadioGraphics Volumen 39, Issue 1Nov 30 2018.
Radiofrequency Ablation of Solitary Eosinophilic Granuloma of Bone, Rodney R. Corby1, Gregory S. Stacy1, Terrance D. Peabody2 and Larry B. Dixon1, American Journal of Roentgenology. 2008; 190: 1492-1494.
Anne G. Osborn, Karen L. Salzman and A. James Barkovich, Diagnostic Imaging – Brain. Second Edition, USA, Marban