
Universidad de Santander UDES
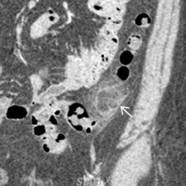
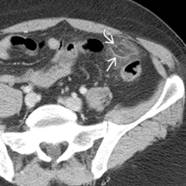
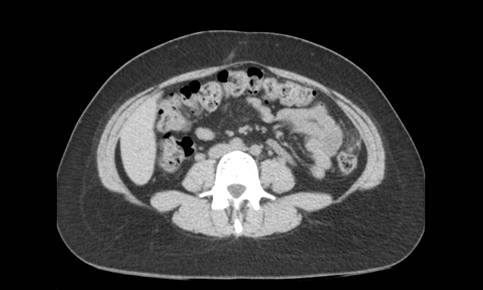
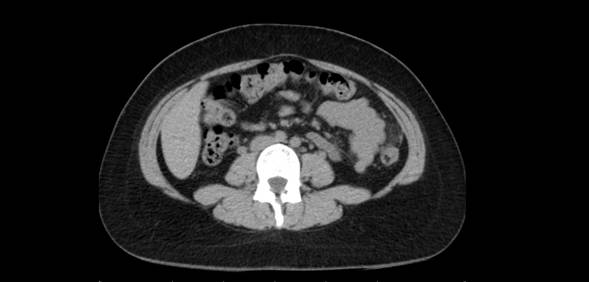
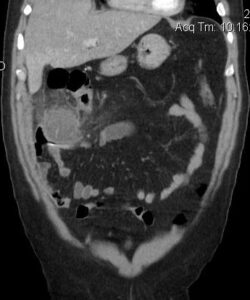
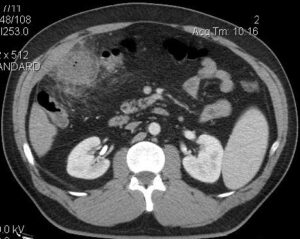
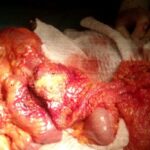
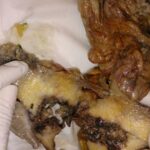
Exponer al paciente para identificar la localización del sitio de origen de un tumor puede ser un trabajo extenso y en ocasiones infructuoso, ya que nos exponemos ante un tumor no identificado, metástasis o los tumores primarios múltiples, los cuales tienen mayor frecuencia en nuestros tiempos por los avances en los métodos diagnósticos.
Estas múltiples neoplasias encontradas en un mismo sujeto y que se definen como tumores primarios múltiples, se estudiaron bajo los criterios de WARREN Y GATES:
1: Cada tumor debe seguir un patrón definido.
2: No deben constituir una metástasis.
3: Cada tumor debe tener una histopatología diferente.
4: Cada tumor debe seguir su historia de enfermedad tumoral y evolución independiente.
Los podemos clasificar en orden del tiempo:
Sincrónicos: Tumores simultáneos o en un intervalo de 6 meses.
Metacrónicos: Tumores que se presentan 6 meses antes o 6 meses después.
Basados en estudios rigurosos se demostró una incidencia de tumores primarios múltiples de 0.73% hasta 5.2% con una media de 2.9%
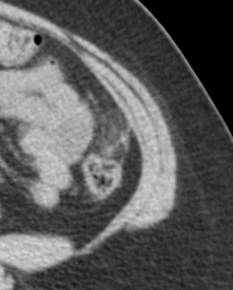
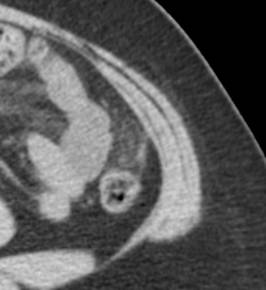
En esta revisión de tema hablaremos de los tumores primarios múltiples de tipo sincrónico o Metacrónicos, que acompañan al cáncer de mama y el cáncer de pulmón.
Tumores primarios múltiples relacionados con cáncer de mama
El cáncer de mama es la neoplasia maligna más frecuente en las mujeres, su mortalidad ha disminuido en un 34% debido a las pesquisas y mejoras en tratamientos.
Se considera que entre 2006 – 2010 la tasa de supervivencia a 5 años mejoró hasta un 78% en comparación a los diagnosticados entre 1993 – 1995.
En una muestra total de 8204 pacientes con cáncer de mama entre 1990–2012 se diagnosticaron en 858 pacientes un total de 962 tumores múltiples primarios, el equivalente a 10.5%.
Se encontró además una mayor frecuencia de tumores Metacrónicos (79%) en relación a tumores sincrónicos (23.8%).
96 pacientes (11.2%) de los 858 mencionados anteriormente presentaron 2 ó más tumores primarios múltiples.
Los primarios múltiples más significativos que acompañaron al cáncer de mama en orden de frecuencia son:
- Glándula Tiroidea: 405 tumores (42 %)
- Sistema Ginecológico: 180 tumores (18.7%)
- Estómago y esófago: 82 tumores (8.5%)
La edad promedio de los pacientes con solo cáncer de mama fue de 48.9 y en los que además del cáncer de mama presentaron un primario múltiple fue de 52.7.
Los tumores primarios múltiples asociados al cáncer de mama disminuyen significativamente la supervivencia a 5 años.
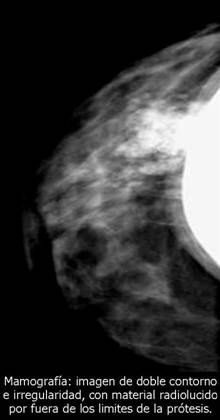
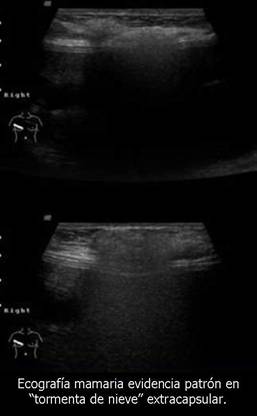
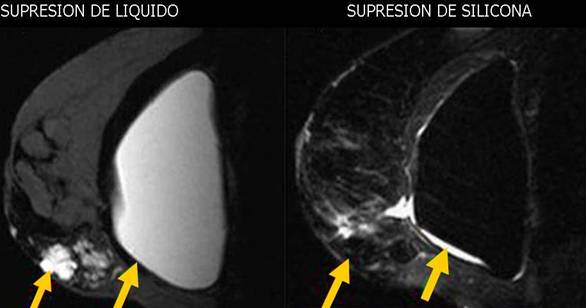
Los tumores primarios no solo se presentan en órganos diferentes a la mama. En un estudio realizado por el hospital juan canalejo de la Coruña, con una muestra de 576 pacientes con cáncer de mama 10 (1.7%) de ellos se presentaban en forma bilateral, y de estos 10 tumores bilaterales se encontraron 6 primarios múltiples (1.04%)
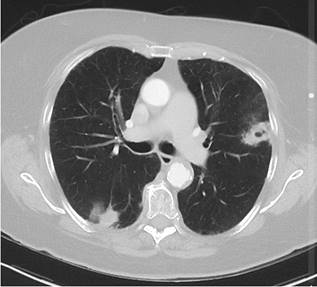
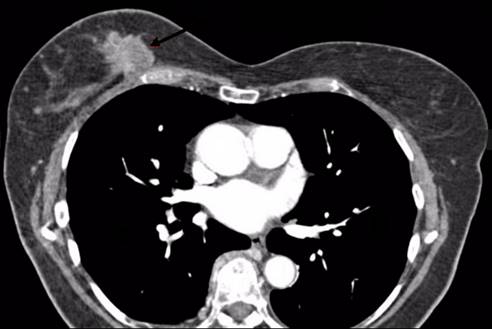
Tumores primarios múltiples relacionados con cáncer de pulmón
En una muestra de 5405 pacientes con cáncer de pulmón, 185 presentaron un tumor primario múltiple (3.4%).
De estos 185 pacientes 10 fueron excluidos quedando como muestra total 175, el 94.6% presentaban un segundo tumor primario y el 5.4% 2 o más tumores múltiples lo cual no era un buen presagio para dichos pacientes ya que la supervivencia era menor.
Se halló una prevalencia mayor de tumores Metacrónicos 111 pacientes (63.5%) sobre los sincrónicos 64 pacientes (36.5%).
Ciertas características halladas en el paciente aumentaban el riesgo de tener un primario múltiple, en orden de frecuencia tenemos:
- Edad: Menores 70 años (63.4%).
- Género: Hombres (71.4%).
- Fumadores: (68%).
- Adenocarcinoma: (60.6%).
Los primarios múltiples más significativos que involucran al cáncer de pulmón en orden de frecuencia son:
- Sistema digestivo: 80 pacientes (45.7%).
- Sistema urogenital: 33 pacientes (18.9%).
- Cabeza y cuello: 34 pacientes (19.4%).
- Sistema linfático y hematopoyético: 11 pacientes (6.3%).
- Otros en los que se incluía a la mama: 17 pacientes (9.7%).
La supervivencia disminuye significativamente en aquellos pacientes quienes además de su tumor primario presentaban un segundo tumor múltiple primario.
En el estudio de “Double Primary Carcinomas of the Lung – José Cáceres » refiere que en 225 pacientes que murieron de tumor broncogénico 9 de ellos para un total del 4% presentaron un segundo carcinoma invasor que no había sido identificado a tiempo.
Conclusión:
Cada vez se piensa más en los tumores primarios múltiples, esto da más alternativas de supervivencia en el paciente y permite dirigir mejor su tratamiento, los estudios que tenemos a la vista nos deben hacer pensar en; si el tumor que se está evidenciando hace parte de un cáncer primario, metástasis o de un tumor primario múltiple (sincrónico/Metacrónico).
Si nos enfrentamos a uno, dos o más tumores múltiples primarios que si bien es cierto la supervivencia es baja el tratamiento sería diferente ya que al recordar la clasificación de Warren y Gates cada tumor tiene su propio curso de enfermedad, diferente histología y no hace parte de una metástasis.
Los tumores Metacrónicos tienen mayor frecuencia sobre los sincrónicos y mayor supervivencia.
En relación con los tumores evidenciados y según estudios rigurosos nos enfrentamos a la posibilidad de un 0.73% hasta 5.2% con una media de 2.9% de tener un tumor primario múltiple.
Los pacientes con cáncer de mama tiene un 10.5% de presentar un segundo tumor múltiple primario, lo cual disminuye significativamente su supervivencia.
Una vez identificado el cáncer de mama debemos revisar exhaustivamente la tiroides, sistema ginecológico, estómago ya que se encontraron con mayor frecuencia neoplasias asociadas en estos órganos.
Los pacientes con cáncer de pulmón tienen un 3.4% de desarrollar un segundo tumor múltiple primario, y se asociaron con neoplasias del sistema digestivo, urogenital, cabeza y cuello como los principales.
No debemos olvidar la posibilidad de tener un segundo tumor primario en un mismo órgano ya que si bien es cierto el porcentaje aunque sea bajo, hay probabilidad de que exista. A manera de recordar cuando estamos ante un tumor primario múltiple tenemos la posibilidad del 1.04% en mama y del 4% en pulmón. Según datos obtenidos en estudios mencionados anteriormente.
BIBLIOGRAFÍA:
Characteristics and Survival of Breast Cancer Patients with Multiple Synchronous or Metachronous Primary Cancers
REV. SENOLOGÍA Y PATOL. MAM. – TUMORES SINCRÓNICOS DE MAMA
Multiple primary malignancies involving lung cancer
Double Primary Carcinomas of the Lung» JOSE CACERES, M.D.,2 and BENJAMIN FELSON, M.D